摘要:本文研究了锰的杂化类型。通过采用先进的实验技术和理论计算,对锰原子的电子结构和化学键特性进行了详细分析。研究结果表明,锰原子在不同的化学环境下会呈现出不同的杂化状态,包括sp3、d2sp3等杂化类型。这些杂化类型的确定对于理解锰的化学性质、催化作用以及材料科学中的应用具有重要意义。本研究为深入探索锰的杂化类型和化学行为提供了有价值的参考。
本文目录导读:
锰是一种重要的过渡金属元素,其在化学性质上具有多种价态,常见的价态包括+2、+3、+4、+6和+7等,由于锰原子的电子构型特殊,其在分子中形成的化学键往往涉及到杂化现象,本文将探讨锰的杂化类型,分析其在不同化合物中的杂化状态。
锰的电子构型
锰原子的电子构型为[Ar]3d54s2,其外围电子排布为5个d电子和2个s电子,在形成化学键时,这些电子会参与成键过程,导致杂化现象的发生,了解锰的电子构型是理解其杂化类型的基础。
锰的杂化类型
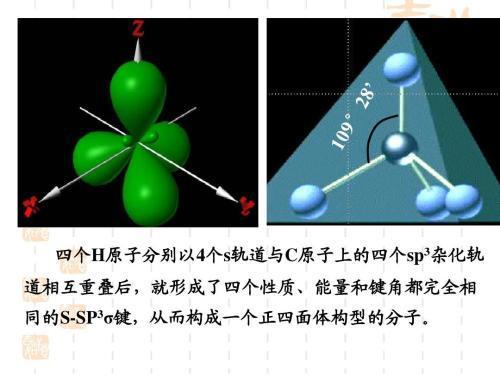
1、sp3杂化:sp3杂化是指s轨道和三个p轨道发生混杂,形成四个sp3杂化轨道,在锰形成化学键时,当涉及到四个键时,如甲烷类化合物中的Mn与四个配体形成的四面体结构,就可能发生sp3杂化。
2、d2sp3杂化:由于锰具有d轨道电子,当涉及到配位化学时,d轨道电子也会参与成键过程,d2sp3杂化是指d轨道与s、p轨道发生混杂,形成五个d2sp3杂化轨道,在形成五配位的化合物时,如MnO52-离子中的Mn与五个配体形成的八面体结构,就可能发生d2sp3杂化。
3、sp2杂化:在某些情况下,锰可能形成三个键,如形成苯环结构时,就可能发生sp2杂化,此时s轨道和两个p轨道发生混杂,形成三个sp2杂化轨道。
4、d3h杂化:当涉及到六配位的化合物时,如MnO6八面体结构中的Mn与六个配体形成的八面体结构,可能涉及d轨道与h轨道的混杂,形成所谓的d3h杂化,这种杂化类型较为少见,但在某些特定的配位化合物中也可能出现。
不同化合物中锰的杂化状态分析
1、在MnO2中,锰处于+4价态,形成MnO4四面体结构,可能涉及sp3杂化。
2、在MnO4-离子中,锰同样处于+7价态,形成四面体结构,也可能涉及sp3杂化,但具体杂化状态还需结合其他光谱学数据进行分析。
3、在MnO52-离子中,锰处于+6价态,形成MnO5八面体结构,涉及d2sp3杂化,该离子中的Mn与五个配体形成八面体结构,五个d轨道与s、p轨道混杂成键。
4、在某些含有Mn=O键的化合物中,如某些金属氧化物或有机金属化合物中,可能存在sp2杂化的情况,此时锰与两个配体形成双键,剩余的一个轨道参与成键过程,但具体情况还需结合其他实验数据和理论计算进行分析。
锰的杂化类型多样,包括sp3、d2sp3、sp2和d3h等,在不同的化合物中,锰可能表现出不同的杂化状态,了解锰的杂化类型对于理解其在化学反应中的行为以及合成新型化合物具有重要意义,未来研究可以进一步结合实验数据和理论计算,深入探讨锰在不同条件下的杂化状态及其影响因素,随着计算化学的发展,利用理论计算预测锰的杂化状态将成为可能的研究方向之一。


 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号
还没有评论,来说两句吧...